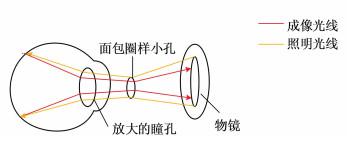
-
摘要: 随着我国社会经济的发展及国人饮食、生活习惯的改变,糖尿病的发病率呈逐年上升趋势。糖尿病视网膜病变(Diabetic Retinopathy,DR)作为糖尿病最为常见的并发症,已成为视力下降甚至致盲的主要原因之一。通过对其早期诊断和及时治疗,超过50%的患者的视力损伤及致盲可得到预防。因此,研究DR的诊断和治疗方法具有重要的临床意义。由于眼部的结构及光学特性,生物医学光子学技术在DR的临床诊断和治疗中已得到了非常广泛的应用并且具有巨大的发展前景。本文综述了目前临床上用于DR诊断和治疗的主要生物医学光子学技术的原理及其最新应用进展,并分析对比了各个技术的特点,最后总结并展望了生物医学光子学技术在临床DR诊断和治疗的发展趋势。Abstract: Diabetic Retinopathy(DR), as the most common complication of diabetes, has become one of the leading cause of vision loss or blindness. More than 50% of the patients with visual impairment or blindness as a result of DR can be prevented by early diagnosis and prompt treatment. Therefore, it is of great clinical significance to study the diagnosis and treatment of DR. Based on the structural and optical properties of eyes, biomedical photonics techniques have been widely used in diagnosis and treatment of DR and show great prospects. In this paper, the principle of biomedical photonics techniques in clinical diagnosis and treatment of DR is reviewed and the characteristics of each technique is analyzed and compared. Finally, the development trend of biomedical photonics technology in clinical DR diagnosis and treatment is prospected.
-
表 1 常用的DR临床诊断技术的比较
Table 1. Comparison of clinical diagnosis technologies for DR
DR诊断技术 优点 缺点 检眼镜 价格低廉、实用、快捷、对黄斑区等细微病变有优势 灵敏度低、需患者高度配合、检查结果无法保存、诊断主观性、不适合大规模筛查 裂隙灯 价格相对低廉、对黄斑水肿的检查有优势 需散瞳、需加用前置镜或接触镜、不适合大规模筛查 眼底照相 非侵入性、数字化成像、操作方便快捷、图像客观、成像迅速、可重复、可储存、可传输、适于大规模筛查和远程医疗 需要大量专业人员进行阅片、无法预测眼底尚未发生改变的患者的DR进程、对黄斑水肿引起的视网膜增厚以及发现细微病变没有优越性 荧光素眼底血管造影 DR诊断的“金标准”、可动态观察视网膜血液循环、血-视网膜屏障、RPE层的生理和病理信息等、能发现微小病变并确定其范围和部位、能确定黄斑部毛细血管无灌注区、发现导致黄斑水肿的毛细血管渗漏、指导视网膜激光光凝治疗 侵入性、造影剂过敏反应、不适合大规模筛查 OCT 在体、实时、非侵入性、无需散瞳、定量测量显微级别的空间分辨率的视网膜形态、定量测量视网膜厚度、监测黄斑水肿等 费用高、易受屈光介质浑浊、患者运动伪影影响无法获得清晰图像、视网膜检查范围有限、无法确定微小病变 表 2 不同的DR激光治疗技术的比较
Table 2. Comparison of different photocoagulation technologies for DR
DR的激光治疗技术 优点 缺点 传统激光光凝 连续波激光、单点激光、能量高 完全热坏死治疗、可能造成周边视觉下降、视野缩小、暗适应下降、对比敏感度下降、机动车驾驶能力受损、加重DME、造成永久的中心视力受损、脉络膜新生血管、激光瘢痕扩大等 Pascal激光光凝 半自动化、多点激光、激光光凝热扩散少、曝光时间短、能量密度低、定位更精准、光斑排列均匀、光凝确切、一次性完成PRP、耗时减少、患者疼痛反应减轻、治疗周期短、周围组织的损伤减小、并发症减少、患者依从性好 对于新生血管的消退、避免其复发的疗效不如传统的氩激光、治疗PDR效果可能不如传统激光 导航激光光凝 激光光凝和活体眼底成像相结合、可自动定位、可记录、安全性好、患者耐受性好、可重复性、能达到很高的准确性 需大量样本进行长时间的随访来进一步验证其安全性 SDM 微脉冲、低能量、限制了激光对RPE层的损伤、没有可见的激光斑 操作费时 视网膜再生疗法 非连续的能量分布的低能倍频纳秒激光脉冲、信号可控制、对RPE层刺激修复而非破坏 需深入的临床研究进一步验证其安全性 SRT 选择性治疗、保留了完整的视觉 激光斑可见、需深入的临床研究来进一步证实其有效性和安全性 -
[1] XU Y, WANG L, HE J, et al.. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9):948-958. doi: 10.1001/jama.2013.168118 [2] 中华医学会眼科学会眼底病学组.我国糖尿病视网膜病变临床诊疗指南(2014)[J].中华眼科杂志, 2014, 50(11):851-865. doi: 10.3760/cma.j.issn.0412-4081.2014.11.014The Chinese Academy of Ophthalmology Eye Disease Study Group. Clinical guidelines for diagnosis and treatment of diabetic retinopathy in China(2014)[J]. Chinese Journal of Ophthalmology, 2014, 50(11):851-865.(in Chinese) doi: 10.3760/cma.j.issn.0412-4081.2014.11.014 [3] CHEUNG N, MITCHELL P, WONG T Y. Diabetic retinopathy[J]. The LANCET, 2010, 376(9735):126-134. [4] EBNETR A, ZINKERNAGEL M S. Novelties in diabetic retinopathy[J]. Endocrine Development, 2015, 31:84-96. http://cn.bing.com/academic/profile?id=83da0d3da1caa499bbcd2a2406ca3c28&encoded=0&v=paper_preview&mkt=zh-cn [5] 徐可欣, 高峰, 赵会娟.生物医学光子学(第2版)[M].北京:科学出版社, 2011.XU K X, GAO F, ZHAO H J. Biomedical Photonics(the second edition)[M]. Beijing:Science Press, 2011.(in Chinese) [6] PARK Y G, ROH Y J. New diagnostic and therapeutic approaches for preventing the progression of diabetic retinopathy[J]. Journal of Diabetes Research, 2015, 2016(4):1753584. http://cn.bing.com/academic/profile?id=c47e1be68b8a5b6e7099e108d91bec80&encoded=0&v=paper_preview&mkt=zh-cn [7] The Diabetic Retinopathy Study Research Group. Photocoagulation treatment of proliferative diabetic retinopathy[J]. Ophthalmology, 1981, 88(7):583-600. doi: 10.1016/S0161-6420(81)34978-1 [8] Early Treatment Diabetic Retinopathy Study Research Group. Early photocoagulation for diabetic retinopathy. ETDRS report number 9[J]. Ophthalmology, 1991, 98(5):766-785. doi: 10.1016/S0161-6420(13)38011-7 [9] MOHAMED Q, GILLIES M C, WONG T Y. Management of diabetic retinopathy:a systematic review[J]. JAMA, 2007, 298(8):902-916. doi: 10.1001/jama.298.8.902 [10] MARTONY C L, BAHN C F, MEYER R F. Slit Lamp:Examination and Photography[M]. Sedona, A Z:Time-One Ink Ltd, 2007. [11] KHALAF S S, ALBDOUR M D, ALTILL M I. Clinical biomicroscopy versus fluorescein angiography:effectiveness and sensitivity in detecting diabetic retinopathy[J]. European Journal of Ophthalmology, 2007, 17(1):84-88. doi: 10.1177/112067210701700112 [12] NANDA D, SARKAR M, SAHU V, et al.. Comparing between slit-lamp biomicroscopy and fluorescein angiography in diagnosing diabetic retinopathy[J]. Scholars Journal of Applied Medical Sciences, 2017, 5(1B):108-111. http://cn.bing.com/academic/profile?id=41d97067153f8bf273921fefeb1825a9&encoded=0&v=paper_preview&mkt=zh-cn [13] 崔桂华.眼底照相机光学系统中杂光和鬼像的控制[J].光学技术, 2000, 26(2):139-141. http://www.cnki.com.cn/Article/CJFDTOTAL-GXJS200002015.htmCUI G H. Control of ghost and scatter light in retinal camera[J]. Optical Technique, 2000, 26(2):139-141.(in Chinese) http://www.cnki.com.cn/Article/CJFDTOTAL-GXJS200002015.htm [14] SHIRAKI K, HARIMURA Y, MORIWAKI M, et al.. Digital fluoresce in fundus angiography with DFC-512 and IMAGEnet systems[J]. European Journal of Ophthalmoogyl, 1991, 1(1):39-44. doi: 10.1177/112067219100100108 [15] 霍妍佼, 魏文斌.眼底成像技术新进展——共聚焦激光扫描检眼镜[J].国际眼科纵览, 2015, 39(4):224-228. http://www.docin.com/p-1359224335.htmlHUO Y J, WEI W B. Progress in fundus imaging:confocal scanning laser opthalmoscope[J]. International Review of Ophthalmology, 2015, 39(4):224-228.(in Chinese) http://www.docin.com/p-1359224335.html [16] FOPS T J B, MMEDSCI C J B. Ophthalmic imaging today:an ophthalmic photographer's viewpoint-a review[J]. Clinical and Experimental Ophthalmology, 2010, 37(1):2-13. http://cn.bing.com/academic/profile?id=3e0026e2665c0a0c45355f02a571f045&encoded=0&v=paper_preview&mkt=zh-cn [17] 李芙蓉, 袁宏志, 张鑫, 等.彩色眼底照相在糖尿病视网膜病变早期筛查中的意义[J].宁夏医学杂志, 2012, 34(9):918-920. http://mall.cnki.net/magazine/article/NXYX201209051.htmLI F R, YUAN H ZH, ZHANG X, et al.. The value of color fundus photography in early diabetic retinopathy screening[J]. Ningxia Medical Journal, 2012, 34(9):918-920.(in Chinese) http://mall.cnki.net/magazine/article/NXYX201209051.htm [18] 白宁艳, 刘雪莲, 徐浩, 等.眼底彩色照相在糖尿病性视网膜病变筛查中的应用[J].中华实用医药杂志, 2009, 9(6):449-450. http://journal.9med.net/upload/201003251258026302.pdfBAI N Y, LIU X L, XU H, et al.. The application of color fundus photography in diabetic retinopathy screening[J]. Chinese Journal of Practical Medicine, 2009, 9(6):449-450.(in Chinese) http://journal.9med.net/upload/201003251258026302.pdf [19] 张蕾, 许维强, 谭荣强, 等.糖尿病视网膜病变筛查方式探讨[J].国际眼科杂志, 2010, 10(3):482-484. http://journal.9med.net/html/qikan/wgkx/gjykzz/20103103/lclz/20100513094327474_527396.htmlZHANG L, XU W Q, TAN R Q, et al.. Study of diabetic retinopathy screening modes[J]. International Journal of Ophthalmology, 2010, 10(3):482-484.(in Chinese) http://journal.9med.net/html/qikan/wgkx/gjykzz/20103103/lclz/20100513094327474_527396.html [20] 全国眼底病协作组.糖尿病视网膜病变分期标准[J].中华眼科杂志, 1985, 21:113. http://industry.wanfangdata.com.cn/dl/Detail/NSTLQK?id=NSTLQK_10.2217-fon.10.26National group of ocular fundus disease. Standard of diabetic retinopathy grading[J]. Chinese Journal of Ophthalmology, 1985, 21:113.(in Chinese) http://industry.wanfangdata.com.cn/dl/Detail/NSTLQK?id=NSTLQK_10.2217-fon.10.26 [21] ROSSES A P O, BEN A J, de SOUZA C F, et al.. Diagnostic performance of retinal digital photography for diabetic retinopathy screening in primary care[J]. Family Practice, 2017, 34(5):546-551. doi: 10.1093/fampra/cmx020 [22] GULSHAN V, PENG L, CORAM M, et al.. Development and validation of a deep learning algorithm for detection of diabetic retinopathy in retinal fundus photographs[J]. JAMA, 2016, 316(22):2402-2410. doi: 10.1001/jama.2016.17216 [23] WEBB R H, HUGHES G W, POMERANTZEFF O. Flying spot TV ophthalmoscope[J]. Applied Optics, 1980, 19(17):2991-2996. doi: 10.1364/AO.19.002991 [24] MAINSTER M A, TIMBERLAKE G T, WEBB R H, et al.. Scanning laser ophthalmoscopy:clinical applications[J]. Ophthalmology, 1982, 89(7):852-857. doi: 10.1016/S0161-6420(82)34714-4 [25] 冯绍鸿, 徐丽.扫描激光检眼镜的基本原理及其临床应用[J].中国实用眼科杂志, 1999, 15(4):199-201. http://www.doc88.com/p-3853717954935.htmlFENG SH H, XU L. The basic principle and clinical application of scanning laser ophthalmoscope[J]. Chinese Journal of Practical Ophthalmology, 1999, 15(4):199-201.(in Chinese) http://www.doc88.com/p-3853717954935.html [26] WEBB R H, HUGHES G W, DELORI F C. Confocal scanning laser ophthalmoscope[J]. Applied Optics, 1987, 26(8):1492-1499. doi: 10.1364/AO.26.001492 [27] SHARP P F, MANIVANNAN A. The scanning laser ophthalmoscope[J]. Physics in Medicine and Biology, 1997, 42(5):951-966. doi: 10.1088/0031-9155/42/5/014 [28] KIRKPATRICK J N, MANIVANNAN A, GUPTA A K, et al.. Fundus imaging in patients with cataract:role for a variable wavelength scanning laser ophthalmoscope[J]. British Journal of Ophthalmology, 1995, 79(10):892-899. doi: 10.1136/bjo.79.10.892 [29] ETTEN P G, BROUWERE D D, WESTERS P, et al.. Zero dilation ophthalmoscopy[J]. The Journal of Ophthalmic Photography, 2014, 36(2):55-62. http://cn.bing.com/academic/profile?id=8c1e43de9a3067e367c3ff0e007b7298&encoded=0&v=paper_preview&mkt=zh-cn [30] ZHU S, TRIEST M V, TONG M, et al.. Retinal vascular tortuosity in hospitalized patients with type 2 diabetes and diabetic retinopathy in China[J]. Journal of Biomedical Science and Engineering, 2016, 9(10):143-154. doi: 10.4236/jbise.2016.910B019 [31] BEKKERS E J, ZHANG J, DUITS R, et al. . Curvature based biomarkers for diabetic retinopathy via exponential curve fits in SE(2)[C]. Ophthalmic Medical Image Analysis Second International Workshop, Munich, Germany, 2015: 113-120. [32] ROMENY B M H, BEKKERS E J, ZHANG J, et al.. Brain-inspired algorithms for retinal image analysis[J]. Machine Vision and Applications, 2016, 27(8):1117-1135. doi: 10.1007/s00138-016-0771-9 [33] SILVA P S, CAVALLERANO J D, SUN J K, et al.. Nomydriatic ultrawide field retinal imaging compared with dilated standard 7-field 35mm photography and retinal specialist examination for evaluation of diabetic retinopathy[J]. American Journal of Ophthalmology, 2012, 154(3):549-559. doi: 10.1016/j.ajo.2012.03.019 [34] KERNT M, HADI I, PINTER F, et al.. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy(Optomap) compared with ETDRS 7-field stereo photography[J]. Diabetes Care, 2012, 35:2459-2463. doi: 10.2337/dc12-0346 [35] HUSSAIN N, EDRAKI M, TAHHAN R, et al.. Telemedicine for diabetic retinopathy screening using an ultra-widefield fundus camera[J]. Clinical Ophthalmology, 2017, 11:1477-1482. doi: 10.2147/OPTH [36] 葛婧菁.便携式双波段荧光眼底血管造影仪的光学设计[J].中国光学, 2013, 6(2):223-230. http://www.chineseoptics.net.cn/CN/abstract/abstract8958.shtmlGE J J. Optical design of portable dual-band fluorescence fundus angiography[J]. Chinese Optics, 2013, 6(2):223-230.(in Chinese) http://www.chineseoptics.net.cn/CN/abstract/abstract8958.shtml [37] 王霞, 裴承华, 丁爱东.眼底荧光血管造影对早期诊断糖尿病性视网膜病变的意义[J].中国医药科学, 2014, 10(16):211-212. doi: 10.3969/j.issn.2095-0616.2014.16.073WANG X, PEI CH H, DING A D. Fundus fluorescein angiography in the early diagnosis of diabetic retinopathy significance[J]. China Medicine and Pharmacy, 2014, 10(16):211-212.(in Chinese) doi: 10.3969/j.issn.2095-0616.2014.16.073 [38] 余兆敏, 宋卫平, 邓晓.眼底荧光血管造影在糖尿病性视网膜病变中的临床应用[J].中国医学工程, 2015(10):86-89. http://www.cqvip.com/QK/87361X/201510/666559526.htmlYU ZH M, SONG W P, DENG X. Clinical application of fundus fluorescence angiography in diabetic retinopathy[J]. China Medical Engineering, 2015(10):86-89.(in Chinese) http://www.cqvip.com/QK/87361X/201510/666559526.html [39] XU D, ZHANG X H, SUN Z, et al.. Evaluating fundus photography and fundus fluorescein angiography in the grading of diabetic retinopathy[J]. Chinese Journal of Experimental Ophthalmology, 2013, 31(8):779-782. http://cn.bing.com/academic/profile?id=0afa132455cf61516a4d5f782292ceb2&encoded=0&v=paper_preview&mkt=zh-cn [40] WESSEL M M, AAKER G D, PARLITSIS G, et al.. Ultra-wide-field angiography improves the detection and classification of diabetic retinopathy[J]. Retina, 2012, 32(4):785-791. doi: 10.1097/IAE.0b013e3182278b64 [41] WESSEL M M, NAIR N, AAKER G D, et al.. Peripheral retinal ischaemia, as evaluated by ultra-widefield fluorescein angiography, is associated with diabetic macular oedema[J]. British Journal of Ophthalmology, 2012, 96:694-698. doi: 10.1136/bjophthalmol-2011-300774 [42] PATEL R D, MESSNER L V, TEITELBAUM B, et al.. Characterization of ischemic index using ultra-widefield fluorescein angiography in patients with focal and diffuse recalcitrant diabetic macular edema[J]. American Journal of Ophthalmology, 2013, 155(6):1038-1044. doi: 10.1016/j.ajo.2013.01.007 [43] SIM D A, KEANE P A, RAJENDRAM R, et al.. Patterns of peripheral retinal and central macula ischemia in diabetic retinopathy as evaluated by ultra-widefield fluorescein angiography[J]. American Journal of Ophthalmology, 2014, 158(1):144-153. doi: 10.1016/j.ajo.2014.03.009 [44] SINGER M, TAN CS, BELL D, et al.. Area of peripheral retinal nonperfusion and treatment response in branch and central retinal vein occlusion[J]. Retina, 2014, 34:1736-1742. doi: 10.1097/IAE.0000000000000148 [45] MUQIT M M, MARCELLINO G R, HENSON D B, et al.. Optos-guided pattern scan laser (Pascal)-targeted retinal photocoagulation in proliferative diabetic retinopathy[J]. Acta Ophthalmologica, 2013, 91:251-258. doi: 10.1111/aos.2013.91.issue-3 [46] SKA M, BERNARDES A B, CARDILLO J A, et al.. Retinal nerve fiber layer thickness profile in normal eyes using third-generation optical coherence tomography[J]. Eye, 2006, 20(4):431-439. doi: 10.1038/sj.eye.6701896 [47] ISHIBAZAWA A, NAGAOKA T, TAKAHASHI A, et al.. Optical coherence tomography angiography in diabetic retinopathy:a prospective pilot study[J]. American Journal of Ophthalmology, 2015, 160(1):35-44. doi: 10.1016/j.ajo.2015.04.021 [48] 刘长秀, 张丽红, 张勤.FFA与OCT对糖尿病性黄斑水肿临床诊断的对比与分析[J].中国中医眼科杂志, 2014(4):275-277. http://www.cnki.com.cn/Article/CJFDTotal-ZGKZ201404017.htmLIU CH X, ZHANG L H, ZHANG Q. Correlation between optical coherence tomography and fundus fluorescence angiography for assessment of diabetic macular edema[J]. Chinese Journal of Chinese Ophthalmology, 2014(4):275-277.(in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-ZGKZ201404017.htm [49] 罗洁, 杨海军, 李小平.频域OCT与FFA在糖尿病视网膜病变患者中的应用[J].眼科新进展, 2015, 35(5):463-466. http://www.cdmd.cnki.com.cn/Article/CDMD-10403-1014116716.htmLUO J, YANG H J, LI X P. Application comparative study on frequency domain OCT and FFA in patients with diabetic retinopathy[J]. Recent Advances in Ophthalmology, 2015, 35(5):463-466.(in Chinese) http://www.cdmd.cnki.com.cn/Article/CDMD-10403-1014116716.htm [50] SPAIDE R F, JR K J, COONEY M J. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography[J]. Jama Ophthalmology, 2015, 133(1):45-50. doi: 10.1001/jamaophthalmol.2014.3616 [51] JIA Y L, TAN O, TOKAYER J, et al.. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography[J]. Optics Express, 2012, 20(4):4710-4725. doi: 10.1364/OL.40.002305 [52] TAM J, DHAMDHERE K P, TIRUVEEDHULA P, et al.. Disruption of the retinal parafoveal capillary network in type 2 diabetes before the onset of diabetic retinopathy[J]. Investigative Ophthalmology and Visual Science, 2011, 52(12):9257-9266. doi: 10.1364/OE.20.004710 [53] LOMBARDO M, PARRAVANO M, SERRAO S, et al.. Analysis of retinal capillaries in patients with type 1 diabetes and nonproliferative diabetic retinopathy using adaptive optics imaging[J]. Retina, 2013, 33(8):1630-1639. doi: 10.1167/iovs.11-8481 [54] ARICHIKA S, UJI A, MURAKAMI T, et al.. Correlation of retinal arterial wall thickness with atherosclerosis predictors in type 2 diabetes without clinical retinopathy[J]. British Journal of Ophthalmology, 2016, 69-74. doi: 10.1097/IAE.0b013e3182899326 [55] LIU C, ZHI Y, WANG B, et al.. In vivo super-resolution retinal imaging through virtually structured detection[J]. Journal of Biomedical Optics, 2016, 21(12):120502. http://cn.bing.com/academic/profile?id=a1e42d54a98868ad7281eb3b8148d3fe&encoded=0&v=paper_preview&mkt=zh-cn [56] ZAMORA G, TRUITT P W, NEMETH S C, et al.. Hyperspectral imag analysis for ophthalmic applications[J]. Proc. SPIE, 2004, 5314:138-149. doi: 10.1117/1.JBO.21.12.120502 [57] LI Q, XUE Y, XIAO G, et al.. New microscopic pushbroom hyperspectral imaging system for application in diabetic retinopathy research[J]. Journal of Biomedical Optics, 2007, 12(6):0640111-0640114. doi: 10.1117/12.530796 [58] TAYYARI F, KHUU L A, FLANAGAN J G, et al.. Retinal blood flow and retinal blood oxygen saturation in mild to moderate diabetic retinopathy[J]. Investigative Ophthalmology and Visual Science, 2015, 56(11):6796-6800. http://cn.bing.com/academic/profile?id=0be76c949ea78893be6b14d474d28414&encoded=0&v=paper_preview&mkt=zh-cn [59] GAO S S, LIU G J, HUANG D, et al.. Optimization of the split-spectrum amplitude-decorrelation angiography algorithm on a spectral optical coherence tomography system[J]. Optics Letters, 2015, 40(10):2305-2308. doi: 10.1167/iovs.15-17481 [60] 李凤鸣.中华眼科学[M].北京:人民卫生出版社, 2005.LI F M. Chinese Ophthalmology[M]. Beijing:People's Medical Press, 2005.(in Chinese) [61] MCBAIN V A, FORRESTER J V, LOIS N. Fundus autofluorescence in the diagnosis of cystoid macular oedema[J]. British Journal of Ophthalmology, 2008, 92(7):946-949. doi: 10.1136/bjo.2007.129957 [62] 张新媛, MARK G, 朱晓青, 等.黄斑囊样水肿患者自发荧光与黄斑色素密度的关系[J].眼科, 2010, 19(5):357-360. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yk201005020ZHANG X Y, MARK G, ZHU X Q, et al.. The correlation study of macular autofluorescence and macular pigment in cystoids macular edema[J]. Ophthalmology in China, 2010, 19(5):357-360.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yk201005020 [63] RUSSO A, MORESCALCHI F, COSTAGLIOLA C, et al.. Comparison of smartphone ophthalmoscopy with slit-lamp biomicroscopy for grading diabetic retinopathy[J]. American Journal of Ophthalmology, 2015, 159(2):360-364. doi: 10.1016/j.ajo.2014.11.008 [64] TOY B C, MYUNG D J, HE L, et al.. Smartphone-based dilated fundus photography and near visual acuity testing as inexpensive screening tools to detect referral warranted diabetic eye disease[J]. Retina, 2016, 36(5):1000-1008. doi: 10.1097/IAE.0000000000000955 [65] 田蓓.糖尿病视网膜病变全视网膜光凝治疗的几个问题[J].眼科, 2014, 23(4):222-225. http://www.cqvip.com/QK/98276X/201404/662150545.htmlTIAN B. Several problems of photocoagulation for diabetic retinopathy[J]. Ophthalmology in China, 2014, 23(4):222-225.(in Chinese) http://www.cqvip.com/QK/98276X/201404/662150545.html [66] 孙心铨, 王燕琪.激光全视网膜光凝术[J].中国实用眼科杂志, 1998(9):514-516. http://mall.cnki.net/magazine/Article/ZZZY809.000.htmSUN X Q, WANG Y Q. Panretinal photocoagulation[J]. Chinese Journal of Practical Ophthalmology, 1998(9):514-516.(in Chinese) http://mall.cnki.net/magazine/Article/ZZZY809.000.htm [67] STRAUBER S F. Photocoagulation for diabetic macular edema. Early treatment diabetic retinopathy study report number 1[J]. Archives of Ophthalmology, 1985, 103(12):1796-1806. doi: 10.1001/archopht.1985.01050120030015 [68] PORTA M, BANDELLO F. Diabetic retinopathy[J]. Diabetologia, 2002, 45(12):1617-1634. doi: 10.1007/s00125-002-0990-7 [69] WOLBARSHT M L, LANDERS M B. The rationale of photocoagulation therapy for proliferative diabetic retinopathy:a review and a model[J]. Ophthalmic Surgery, 1980, 11(4):235-245. http://cn.bing.com/academic/profile?id=2b4a7a24323dd259876675c5edf2d0cc&encoded=0&v=paper_preview&mkt=zh-cn [70] STEFÁNSSON E. The therapeutic effects of retinal laser treatment and vitrectomy:A theory based on oxygen and vascular physiology[J]. Acta Ophthalmologic a Scandinavica, 2001, 79(5):435-440. doi: 10.1034/j.1600-0420.2001.790502.x [71] BRESNICK G H. Diabetic maculopathy:A critical review highlighting diffuse macular edema[J]. Ophthalmology, 1983, 90(11):1301-1317. doi: 10.1016/S0161-6420(83)34388-8 [72] SPRANGER J, HAMMES H P, PREISSNER K T, et al.. Release of the angiogenesis inhibitor angiostatin in patients with proliferative diabetic retinopathy:association with retinal photo-coagulation[J]. Diabetologia, 2000, 43(11):1404-1407. doi: 10.1007/s001250051546 [73] MMK M, HENSON D B, YOUNG L B, et al.. Single-session versus multiple-session pattern scanning laser(Pascal) panretinal photocoagulation in proliferative diabetic retinopathy:the manchester pascal, study[J]. Archives Ophthalmology, 2010, 128(5):525-533. doi: 10.1001/archophthalmol.2010.60 [74] 彭志华, 程谷萌, 吴岚.Pascal模式扫描光凝治疗糖尿病视网膜病变的疗效观察[J].国际眼科杂志, 2013, 13(8):1639-1641. doi: 10.3980/j.issn.1672-5123.2013.08.38PENG ZH H, CHENG G M, WU L. Observation of clinical efficacy of pattern scan laser photocoagulation on diabetic retinopathy[J]. International Joural of Ophthalmology, 2013, 13(8):1639-1641.(in Chinese) doi: 10.3980/j.issn.1672-5123.2013.08.38 [75] 刘卫, 张勇进, 徐格致.频域相干光断层扫描对PASCAL光凝治疗糖尿病性黄斑水肿后视网膜微结构观察[J].中国眼耳鼻喉杂志, 2014, 14(4):218-222. http://www.cnki.com.cn/Article/CJFDTOTAL-YWLC201511051.htmLIU W, ZHANG Y J, XU G ZH. In vivo retinal micro-architecture observation after PASCAL photocoagulation treatment in diabetic macular edema by using spectral-domain optical coherence tomography[J]. Chinese Journal of Ophthalmology and Otorhinolaryngology, 2014, 14(4):218-222.(in Chinese) http://www.cnki.com.cn/Article/CJFDTOTAL-YWLC201511051.htm [76] MUKHEAR A, KHAN M S, JUNEJO M, et al.. Effect of pan retinal photocoagulation on central macular thickness and visual acuity in proliferative diabetic retinopathy[J]. Pakistan Journal of Medical Sciences, 2016;32(1):221-224. http://cn.bing.com/academic/profile?id=a1af5b0efe6a591f359b07a3beceef03&encoded=0&v=paper_preview&mkt=zh-cn [77] CHAPPELOW A V, TAN K, WAHEED N K, et al.. Panretinal photocoagulation for proliferative diabetic retinopathy:pattern scan laser versus argon laser[J]. American Journal of Ophthalmology, 2012;153(1):137-142. doi: 10.1016/j.ajo.2011.05.035 [78] 董如娇, 陈芳, 李冬育, 等.PASCAL激光与氪离子激光治疗糖尿病视网膜病变观察分析[J].中国实用眼科杂志, 2014, 32(7):849-851. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zgsyykzz201407012DONG R J, CHEN F, LI D Y, et al.. Clinical analysis of PASCAL laser and Krypton ion laser treatment of diabetic retinopathy[J]. Chinese Journal of Practical Ophthalmology, 2014, 32(7):849-851.(in Chinese) http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zgsyykzz201407012 [79] LOCK H J. An update on retinal laser therapy[J]. Clinical and Experimental Optometry, 2011, 94(1):43-51. doi: 10.1111/j.1444-0938.2010.00529.x [80] KERNT M, CHEUTEU R, VOUNOTRYPIDIS E, et al.. Focal and panretinal photocoagulation with a navigated laser(NAVILAS)[J]. Acta Ophthalmologica, 2011, 89(8):662-664. doi: 10.1111/aos.2011.89.issue-8 [81] CHALAM K V, MURTHY R K, BRAR V, et al.. Evaluation of a novel, non-contact, automated focal laser with integrated(NAVILAS) fluorescein angiography for diabetic macular edema[J]. Middle East African Journal of Ophthalmology, 2012, 19(1):158-162. doi: 10.4103/0974-9233.92134 [82] NEUBAUER A S, LANGER J, LIEGL R, et al.. Navigated macular laser decreases retreatment rate for diabetic macular edema:a comparison with conventional macular laser[J]. Clinical Ophthalmology, 2013, 7(1):121-128. http://cn.bing.com/academic/profile?id=b2958ef7aaeddc2e86c46a7194881206&encoded=0&v=paper_preview&mkt=zh-cn [83] CHHABLANI J, KOZAK I, BARTESELLI G, et al.. A novel navigated laser system brings new efficacy to the treatment of retinovascular disorders[J]. Oman Journal of Ophthalmology, 2013, 6(1):18-22. doi: 10.4103/0974-620X.111898 [84] SIVAPRASAD S, ELAGOUZ M, MCHUGH D, et al.. Micropulsed diode laser therapy:evolution and clinical applications[J]. Survey of Ophthalmology, 2010, 55(6):516-530. doi: 10.1016/j.survophthal.2010.02.005 [85] DORIN G. Subthreshold and micropulse diode laser photocoagulation[J]. Seminars in Ophthalmology, 2003, 18(3):147-153. doi: 10.1076/soph.18.3.147.29812 [86] GAO X J, XING D. Molecular mechanisms of cell proliferation induced by low power laser irradiation[J]. Journal of Biomedical Science, 2009, 16(4):doi: 10.1186/1423-0127-16-4. [87] SRAMEK C, MACKANOS M, SPITLER R, et al.. Non-damaging retinal phototherapy:dynamic range of heat shock protein expression[J]. Investigative Ophthalmology and Visual Science, 2011, 52(3):1780-1787. doi: 10.1167/iovs.10-5917 [88] LUTTRULL J K, MUSCH D C, MAINSTER M A. Subthreshold diode micropulse photocoagulation for the treatment of clinically significant diabetic macular edema[J]. British Journal of Ophthalmology, 2005, 89(1):74-80. doi: 10.1136/bjo.2004.051540 [89] LUTTRULL J K, GIORGIO D. Subthreshold diode micropulse laser photocoagulation(SDM) as invisible retinal phototherapy for diabetic macular edema:a review[J]. Current Diabetes Reviews, 2012, 8(4):274-284. doi: 10.2174/157339912800840523 [90] LAURSEN M L, MOELLER F, SANDER B, et al.. Subthreshold micropulse diode laser treatment in diabetic macular edema[J]. British Journal of Ophthalmology, 2004, 88(9):1173-1179. doi: 10.1136/bjo.2003.040949 [91] LUTTRULL J K, MUSCH D C, SPINK C A. Subthreshold diode micropulse panretinal photocoagulation for proliferative diabetic retinopathy[J]. Eye, 2008, 22(5):607-612. doi: 10.1038/sj.eye.6702725 [92] FIGUEIRA J, KHAN J, NUNES S, et al.. Prospective randomized controlled trial comparing sub-threshold micropulse diode laser photocoagulation and conventional green laser for clinically significant diabetic macular edema[J]. British Journal of Ophthalmology, 2009, 93(10):1341-1344. doi: 10.1136/bjo.2008.146712 [93] DPHIL R J C F, FRANZCO G R, FRANZCO H S N, et al.. Pilot randomized trial of a nanopulse retinal laser versus conventional photocoagulation for the treatment of diabetic macular oedema[J]. Clinical and Experimental Ophthalmology, 2012, 40(6):604-610. doi: 10.1111/ceo.2012.40.issue-6 [94] PELOSINI L, HAMILTON R, MOHAMED M, et al.. Retina rejuvenation therapy for diabetic macular edema:a pilot study[J]. Retina, 2013, 33(3):548-558. doi: 10.1097/IAE.0b013e3182670fea [95] PARK Y, SEIFERT E, ROH Y J, et al.. Tissue response of selective retina therapy by means of a feedback-controlled energy ramping mode[J]. Clinical and Experimental Ophthalmology, 2015, 42(9):846-855. http://cn.bing.com/academic/profile?id=f06f94ef7c320aa8dbff26da8c1f1426&encoded=0&v=paper_preview&mkt=zh-cn [96] REDDY S, HU A, SCHWARTZ S D. Ultra wide field fluorescein angiography guided targeted retinal photocoagulation(TRP)[J]. Seminars in Ophthalmology, 2009, 24(1):9-14. doi: 10.1080/08820530802519899 [97] SATO Y, KOJIMAHARA N, KITANO S, et al.. Multicenter randomized clinical trial of retinal photocoagulation for preproliferative diabetic retinopathy[J]. Japanese Journal of Ophthalmology, 2012, 56(1):52-59. doi: 10.1007/s10384-011-0095-2 -





 下载:
下载: